Data:03.10.12
Aluna(s): Diana Coppes (08) ,Milena Pessôa (39)
Professora:Carol
Disciplina:Ciências
Tema:Efeito estufa e Aquecimento global
Efeito estufa

O efeito estufa tem colaborado com o aumento da temperatura no globo terrestre nas últimas décadas. Pesquisas recentes indicaram que o século XX foi o mais quente dos últimos 500 anos. Pesquisadores do clima afirmam que, num futuro próximo, o aumento da temperatura provocado pelo efeito estufa poderá ocasionar o derretimento das calotas polares e o aumento do nível dos mares. Como conseqüência, muitas cidades litorâneas poderão desaparecer do mapa.
Como é gerado
O efeito estufa é gerado pela derrubada de florestas e pela queimada das mesmas, pois são elas que regulam a temperatura, os ventos e o nível de chuvas em diversas regiões. Como as florestas estão diminuindo no mundo, a temperatura terrestre tem aumentado na mesma proporção.
.jpg)
Um outro fator que está gerando o efeito estufa é o lançamento de gases poluentes na atmosfera, principalmente os que resultam da queima de combustíveis fósseis. A queima do óleo diesel e da gasolina nos grandes centros urbanos tem colaborado para o efeito estufa. O dióxido de carbono (gás carbônico) e o monóxido de carbono ficam concentrados em determinadas regiões da atmosfera formando uma camada que bloqueia a dissipação do calor. Outros gases que contribuem para este processo são: gás metano, óxido nitroso e óxidos de nitrogênio. Esta camada de poluentes, tão visível nas grandes cidades, funciona como um isolante térmico do planeta Terra. O calor fica retido nas camadas mais baixas da atmosfera trazendo graves problemas ao planeta.
Problemas futuros
Pesquisadores do meio ambiente já estão prevendo os problemas futuros que poderão atingir nosso planeta caso esta situação persista. Muitos ecossistemas poderão ser atingidos e espécies vegetais e animais poderão ser extintos. Derretimento de geleiras e alagamento de ilhas e regiões litorâneas. Tufões, furacões, maremotos e enchentes poderão ocorrer com mais intensidade. Estas alterações climáticas poderão influenciar negativamente na produção agrícola de vários países, reduzindo a quantidade de alimentos em nosso planeta. A elevação da temperatura nos mares poderia ocasionar o desvio de curso de correntes marítimas, ocasionando a extinção de vários animais marinhos e diminuir a quantidade de peixes nos mares.
Soluções e medidas tomadas contra o efeito estufa
Preocupados com estes problemas, organismos internacionais, ONGs (Organizações Não Governamentais) e governos de diversos países já estão tomando medidas para reduzir a poluição ambiental e a emissão de gases na atmosfera. O Protocolo de Kyoto, assinado em 1997, prevê a redução de gases poluentes para os próximos anos. Porém, países como os Estados Unidos tem dificultado o avanço destes acordos. Os EUA alegam que a redução da emissão de gases poluentes poderia dificultar o avanço das indústrias no país.
Em dezembro de 2007, outro evento importante aconteceu na cidade de Bali. Representantes de centenas de países começaram a definir medidas para a redução da emissão de gases poluentes. São medidas que deverão ser tomadas pelos países após 2012.
Aquecimento Global
.jpg)
Todos os dias acompanhamos na televisão, nos jornais e revistas as catástrofes climáticas e as mudanças que estão ocorrendo, rapidamente, no clima mundial. Nunca se viu mudanças tão rápidas e com efeitos devastadores como tem ocorrido nos últimos anos.
A Europa tem sido castigada por ondas de calor de até 40 graus centígrados, ciclones atingem o Brasil (principalmente a costa sul e sudeste), o número de desertos aumenta a cada dia, fortes furacões causam mortes e destruição em várias regiões do planeta e as calotas polares estão derretendo (fator que pode ocasionar o avanço dos oceanos sobre cidades litorâneas). O que pode estar provocando tudo isso? Os cientistas são unânimes em afirmar que o aquecimento global está relacionado a todos estes acontecimentos.
Pesquisadores do clima mundial afirmam que este aquecimento global está ocorrendo em função do aumento da emissão de gases poluentes, principalmente, derivados da queima de combustíveis fósseis (gasolina, diesel, etc), na atmosfera. Estes gases (ozônio, dióxido de carbono, metano, óxido nitroso e monóxido de carbono) formam uma camada de poluentes, de difícil dispersão, causando o famoso efeito estufa. Este fenômeno ocorre, pois, estes gases absorvem grande parte da radiação infra-vermelha emitida pela Terra, dificultando a dispersão do calor.
O desmatamento e a queimada de florestas e matas também colabora para este processo. Os raios do Sol atingem o solo e irradiam calor na atmosfera. Como esta camada de poluentes dificulta a dispersão do calor, o resultado é o aumento da temperatura global. Embora este fenômeno ocorra de forma mais evidente nas grandes cidades, já se verifica suas conseqüências em nível global.
Consequências do aquecimento global
- Aumento do nível dos oceanos: com o aumento da temperatura no mundo, está em curso o derretimento das calotas polares. Ao aumentar o nível da águas dos oceanos, podem ocorrer, futuramente, a submersão de muitas cidades litorâneas;
- Crescimento e surgimento de desertos: o aumento da temperatura provoca a morte de várias espécies animais e vegetais, desequilibrando vários ecossistemas. Somado ao desmatamento que vem ocorrendo, principalmente em florestas de países tropicais (Brasil, países africanos), a tendência é aumentar cada vez mais as regiões desérticas do planeta Terra;
- Aumento de furacões, tufões e ciclones: o aumento da temperatura faz com que ocorra maior evaporação das águas dos oceanos, potencializando estes tipos de catástrofes climáticas;
- Ondas de calor: regiões de temperaturas amenas tem sofrido com as ondas de calor. No verão europeu, por exemplo, tem se verificado uma intensa onda de calor, provocando até mesmo mortes de idosos e crianças.
- Aumento do nível dos oceanos: com o aumento da temperatura no mundo, está em curso o derretimento das calotas polares. Ao aumentar o nível da águas dos oceanos, podem ocorrer, futuramente, a submersão de muitas cidades litorâneas;
- Crescimento e surgimento de desertos: o aumento da temperatura provoca a morte de várias espécies animais e vegetais, desequilibrando vários ecossistemas. Somado ao desmatamento que vem ocorrendo, principalmente em florestas de países tropicais (Brasil, países africanos), a tendência é aumentar cada vez mais as regiões desérticas do planeta Terra;
- Aumento de furacões, tufões e ciclones: o aumento da temperatura faz com que ocorra maior evaporação das águas dos oceanos, potencializando estes tipos de catástrofes climáticas;
- Ondas de calor: regiões de temperaturas amenas tem sofrido com as ondas de calor. No verão europeu, por exemplo, tem se verificado uma intensa onda de calor, provocando até mesmo mortes de idosos e crianças.

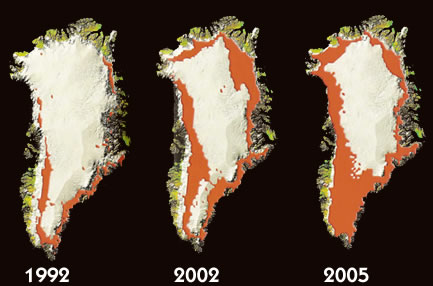
a aceleraçao do gelo na calota polarda groelandia
a a duplicou nos utimos 25 anos